Un enlace determina
Atención : Un poderoso enlace define el comportamiento del agua
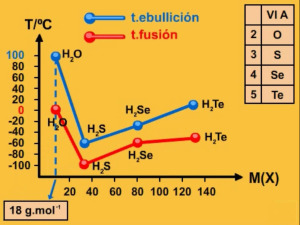
A diferencia del resto de los compuestos hidrogenados de los elementos del grupo VI-A de la Tabla Periódica o hidruros de estructura similar al agua, ésta posee elevadas temperaturas de fusión y ebullición a pesar de tener la menor masa molar ¿por qué?
Fundamental : Enlace por puentes de hidrógeno
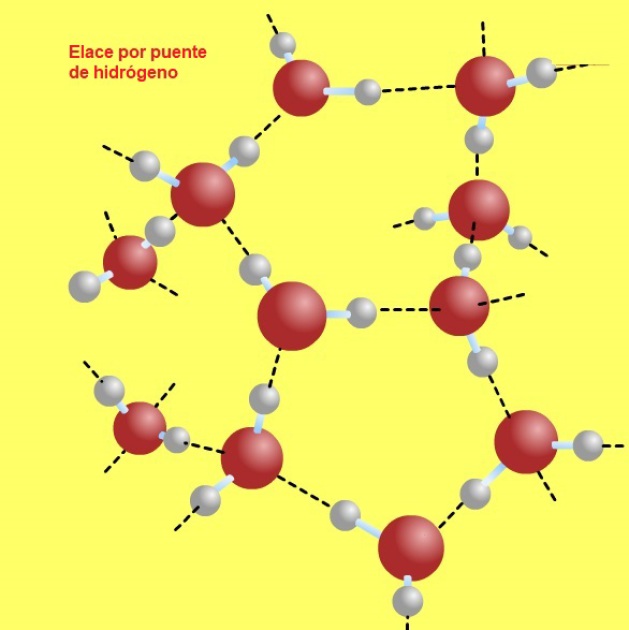
Muchas de las aplicaciones del agua tienen que ver con la polaridad de sus moléculas debido a las características estructurales de los átomos de hidrógeno y oxígeno que la conforman, la disposición de esos átomos en la molécula y las fuertes interacciones que se establecen entre ellas por los llamados puentes de hidrógeno entre el hidrógeno de una molécula y el oxígeno de otra.
La estructura del agua determina las propiedades físicas y químicas.
La estructura determina las propiedades
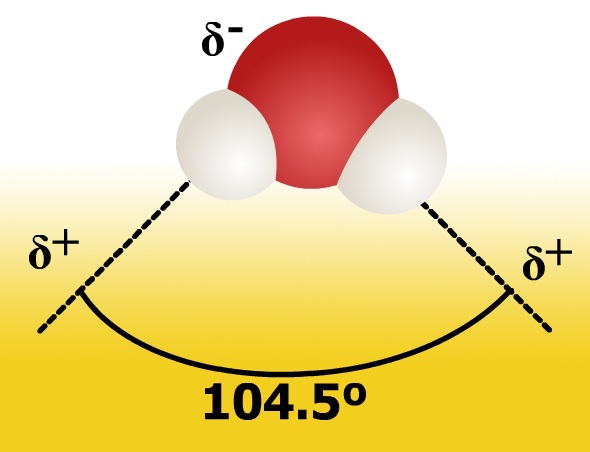
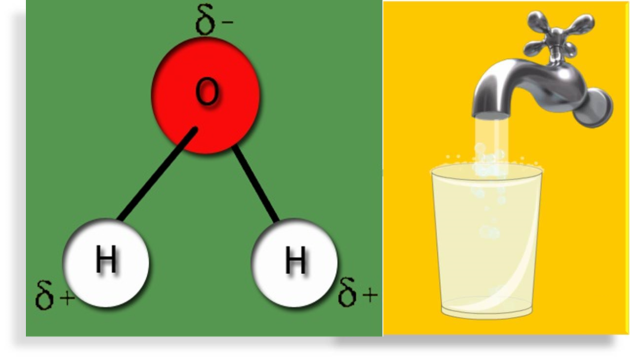
El agua es una sustancia formada por moléculas polares, en las cuales un átomo del elemento químico oxígeno se une a dos átomos del elemento químico hidrógeno por medio de un enlace covalente polar, ya que en el enlace O−H, el par de electrones compartido, es más atraído por el átomo de oxígeno por ser el más electronegativo.
Además en las moléculas de agua, el ángulo H-O-H[1] tiene un valor de 104,5°. Esto provoca que aparezcan cargas parciales positivas δ+ en los átomos de hidrógeno y cargas parciales negativas δ- en los átomos de oxígeno.
La polaridad y el fenómeno de la acción disolvente del agua.
El poder disolvente del agua
¿Te has preguntado por qué el agua disuelve muchas sustancias?, ¿por qué es considerada el disolvente universal?
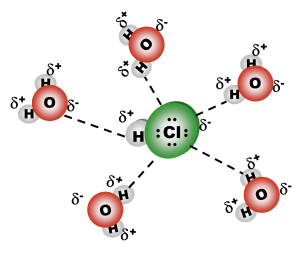
El agua disuelve muchas sustancias iónicas, mediante un proceso de disociación que se establece entre los iones del cristal, pues debilita los enlaces que mantienen unidos los iones, estableciéndose entre el agua y los iones de la red cristalina, una interacción ion-dipolo. Este carácter polar es en buena medida el responsable del empleo del agua en la preparación de fármacos, productos de higiene y hasta algunos refrescos y confitura.
El agua, además de disociar compuestos iónicos como las sales, puede manifestar también su acción como disolvente mediante el establecimiento de enlaces de hidrógeno con otras moléculas que contienen grupos funcionales polares, como alcoholes, aldehídos o cetonas, o puede ionizar compuestos polares como el cloruro de hidrógeno y el amoníaco, estas propiedades abren un campo de aplicaciones de muchas disoluciones.
Muchos hidróxidos no metálicos y compuestos binarios hidrogenados son solubles en agua porque son compuestos formados por moléculas polares igual que el agua, y al mezclarse se producen interacciones de tipo dipolo dipolo que favorece la ionización de la sustancia.
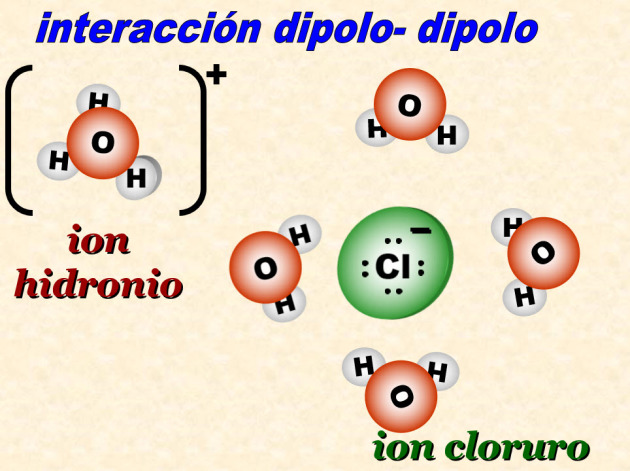
Al ocurrir la interacción dipolo dipolo la molécula de cloruro de hidrógeno que interactúa con el agua se ioniza formándose el ion hidronio (que es la especie resultante de la unión de un protón hidrógeno con el agua) con carga positiva y el ion cloruro con carga negativa, rodeado de otras 4 moléculas de agua.
Meditar : En caso de escape de amoníaco ¿qué hacer?
El amoníaco al igual que el cloruro de hidrógeno es un compuesto binario hidrogenado molecular muy soluble en agua. En caso de estar en presencia de un escape de este gas altamente irritante pero fuertemente soluble en agua por su polaridad y la acción ionizante del agua para con este tipo de sustancias, debes humedecer un paño y colocarlo en tu nariz. El gas quedará atrapado en el paño al ionizarse en presencia del agua contenida en el paño y tu no te asfixiarás por la concentración de un gas tan penetrante.

Carácter ácido base de la disolución
Cada disolución tiene su carácter
En estos procesos la especie química que capta al ion hidrógeno (H+), se le llama base y la especie química que cede (H+) es el ácido. Estas definiciones corresponden a la Teoría ácido base de Bronsted Lowry
Las sustancias que aceptan o donan protones hidrógeno se denominan protólitos y que los procesos donde esto ocurre procesos protolíticos. El agua puede actuar como ácido o como base en dependencia de la especie con la cual interactúe. Puede darse el caso incluso del fenómeno de la autoprotólisis del agua.