Propiedades físicas del agua
Algunas propiedades del agua

Para ti no debe ser difícil entender que cuando hace calor, acercarse a las costas o playas te ayuda a sentir un ambiente más fresco ¿Sabías que en pleno invierno donde menos frío hace es también cerca de las costas o playas?
Propiedades que no implican rupturas intramoleculares[1] en el agua se destacan por su incidencia en la regulación del clima.
Las propiedades físicas[2] del agua hacen posible que los mares, ríos y lagos contribuyan a la moderación del clima[3] en las zonas costeras y lugares aledaños.
¿Por qué el agua regula el clima?
Capacidad térmica específica

Si observas con detenimiento el parte meteorológico en las noticias verás que tanto en el intenso verano como en el crudo invierno las zonas más afectadas son las zonas más alejadas de la costa, ¿te has preguntado por qué?
A consecuencia de su capacidad térmica específica[4] y de la gran cantidad de energía que pone en juego cuando cambia su estado de agregación el agua puede regular el clima.
Cuando se eleva la temperatura en 1 grado celsius una muestra de 1g de agua absorbe del ambiente 4,184 J de energía mediante calor, pero cuando la temperatura disminuye en 1 grado celsius, cada gramo de agua desprende 4,184 J de energía mediante calor.
Observación : Para refrescar o para calentar, la zona costera es ideal

Durante el día la temperatura no se eleva demasiado porque el agua absorbe la energía. Durante la noche la energía se libera con el descenso menos marcado de la temperatura. Este fenómeno es gracias a la propiedad de la capacidad térmica del agua.
El agua en sistemas de enfriamiento
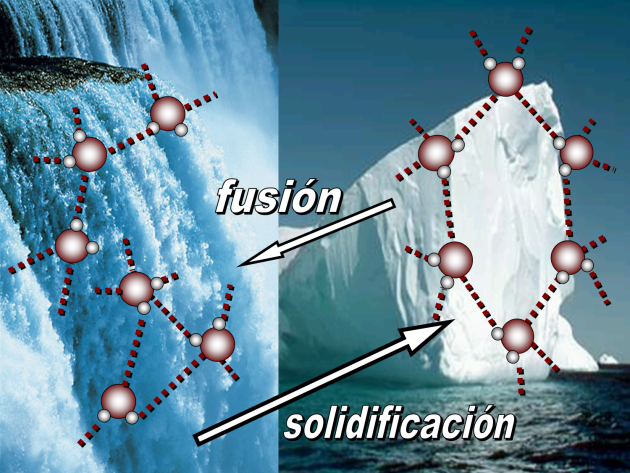
Entalpía de fusión molar
El agua tiene una considerable entalpía de fusión molar[5] cuando pasa del estado sólido al líquido.
El agua en sistemas de calefacción
Entalpía de vaporización molar
El agua tiene una considerable [5]entalpía de vaporización molar[6] cuando pasa del estado líquido al estado gas.
Cuando 1 mol de agua pasa del estado líquido al estado gas, absorbe 40,7 kJ·mol-1 de energía.
Aplicación práctica : Calor adentro de casa

En países muy fríos sería muy difícil sobrevivir al crudo invierno sin sistemas de calefacción en los locales de estancia. Hay diferentes sistemas de calentar el agua, por ejemplo con corriente elécrica y por calentamiento solar.
Estudio de caso : El vapor de agua quema a más de 100 grados
En la televisión explicaron el fenómeno que ocurrió en una planta termoeléctrica donde se fracturó la caldera de vapor de agua y el personal en las zonas aledañas sufrieron intensas quemaduras de tercer grado con peligro para la vida. Sucede que el agua desprende 40,7 kJ cuando pasa de su estado líquido al estado gaseoso, por eso las quemaduras con vapor de agua producen un mayor daño, ya que a la temperatura de 100 ºC del vapor de agua, se le adiciona un aumento de temperatura debido a la energía desprendida en el cambio de estado de líquido a vapor.
Si flota el hielo, es gracias a su densidad
Densidad del agua
La densidad[7] es una de esas propiedades del agua que la hace una sustancia "suigéneris" la casi totalidad de las sustancias forman sólidos de mayor densidad que el líquido, no así sucede con el agua que varía su densidad con la temperatura. A valores inferiores a la temperatura de ebullición[8] y hasta 4 grados C el agua como el resto de las sustancias se contrae, alcanzando una densidad de 1 g/cm3 pero por debajo de esa temperatura y hasta alcanzar la solidificación a cero grados C, el agua comienza a expandirse y su densidad disminuye. Por ello el sólido flota en el agua.
La mayor densidad del agua al estado sólido se alcanza aproximadamente a los 4 grados Celsius. En ese estado se mantiene constante la cantidad de moléculas de agua que a temperatura ambiente se encontraban al estado líquido, pero varía el volumen de los agregados moleculares que se expanden al disminuir la temperatura, logrando que disminuya la densidad del hielo por lo que este puede flotar y permitir la vida de animales marinos como ocurre en las regiones polares.
Estudio de caso : Experimento dentro de la nevera
Una alumna fue preocupada a ver a su profesor de Química porque al colocar un recipiente lleno de agua en la nevera y dejar que el líquido solidificara pareciera que el agua aumentara su cantidad, pues el hielo desbordaba el recipiente. ¿Sabes a qué se debe eso?
Ejemplo : Los animales de zonas polares agradecen al agua

La rareza de que el agua sólida (el hielo) flote sobre el agua líquida es muy afortunada para la vida, ya que al flotar hielo sobre agua líquida el hielo forma una capa que impide que los lagos, ríos e incluso mares se congelen por completo en los climas fríos lo que haría imposible la vida en esos ecosistemas e incluso en los océanos.