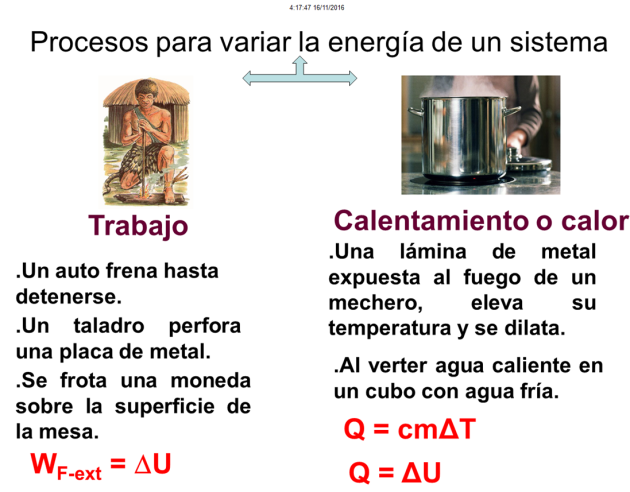
Primera ley de la termodinámica
El trabajo y el calor son dos de los procesos mediante los cuales se transfiere la energía de unos cuerpos a otros. La equivalencia entre estos dos procesos quedó establecida por Joule con el establecimiento del equivalente mecánico del calor.
Tanto el calor como el trabajo representan cambios que ocurren en un proceso. Generalmente estos cambios van acompañados de un variación de la energía interna de sistema.
Sistema termodinámico
Al estudiar las transformaciones de calor en trabajo y viceversa, es necesario conocer qué es un sistema termodinámico.
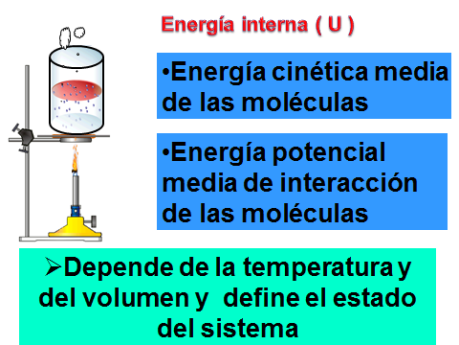
Un sistema se encuentra en equilibrio termodinámico cuando los valores medios de las magnitudes macroscópicas que determinan su estado son independientes del tiempo.
Se dice que un sistema se encuentra en equilibrio termodinámico, si no hay una fuerza resultante que actúe sobre el sistema y si la temperatura del sistema es la misma que la de los alrededores. Esta condición establece que no se realiza trabajo ni sobre el sistema, ni por el sistema, no hay intercambio de calor entre el sistema y sus alrededores. En estas condiciones el sistema posee energía interna definida U.
Un sistema de este tipo puede describirse por tres coordenadas termodinámicas: (P; V; T).
Recuerda que... :
Primera ley de la termodinámica
Consideremos un proceso termodinámico en el que un sistema es obligado a cambiar de un estado de equilibrio 1 a un estado de equilibrio 2. En la figura:
(a)--- el sistema se encuentra en equilibrio termodinámico con una energía interna U y coordenadas termodinámicas (P1; V1; T1)
(b)--- el sistema reacciona con sus alrededores. El calor Q puede ser absorbido por el sistema o liberado por este al ambiente.
Calor | Trabajo |
|---|---|
La transferencia de calor se considera positiva para el calor de entrada y negativa para el calor de salida. El calor neto absorbido por el sistema se representa por ΔQ. | El trabajo puede ser realizado por el sistema, sobre el sistema o ambos casos. El trabajo de salida se considera positivo y el de entrada negativo. El trabajo neto realizado por el sistema se representa por ΔW (trabajo de salida). |
En la figura C el sistema ha alcanzado su estado final y se encuentra nuevamente en equilibrio y se caracteriza por: energía interna U2 Sus parámetros de estados son: (P2; V2; T2) | |
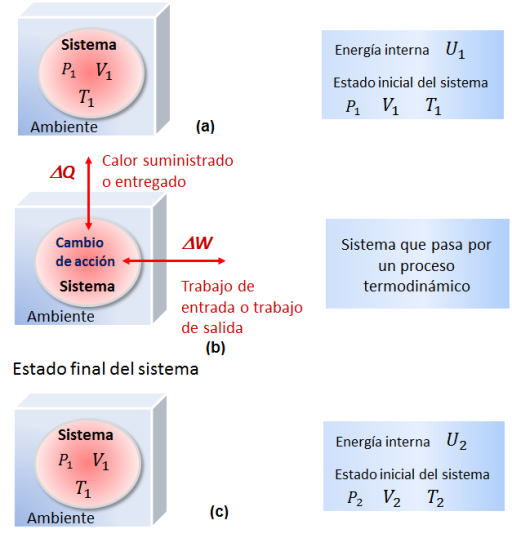
Como la energía se conserva, la variación de la energía interna:
ΔU= U2 - U1
debe representar la diferencia entre el el calor absorbido ΔQ, por el sistema y el trabajo ΔW que se realiza sobre el ambiente.
Así,
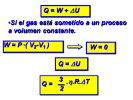
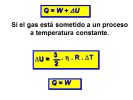
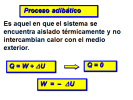
ΔU = ΔQ - ΔW
: Primera ley de la termodinámica

La cantidad de calor (Q) intercambiada por un sistema con el medio, es igual al trabajo (W) realizado por el sistema, más la variación de la energía interna (∆U) .
Enlaces de interés
En los siguientes enlaces encontrarás información esencial para el estudio de las leyes o principios de la termodinámica[1].
Además podrás consultar algunos ejercicios resueltos y otras cuestiones de interés.
: Enlaces de interés

Primer principio de la Termodinámica