Enlace covalente polar
Recuerda que... :
El enlace covalente es la unión química entre dos átomos donde se comparten electrones
¿Sabías que...? :
Gilbert Newton Lewis fisicoquímico norteamericano, (1946-1875). Realizó numerosas investigaciones en el campo científico, pero fue su teoría sobre los enlaces químicos y su definición de ácido-base, lo que lo hizo especialmente famoso. En 1916 promulgó una teoría sobre los enlaces covalentes, que serían profundizadas y divulgadas años más tarde.

¿Qué diferencia existe entre el enlace que une a las sustancias simples no metálicas y los óxidos no metálicos?
:
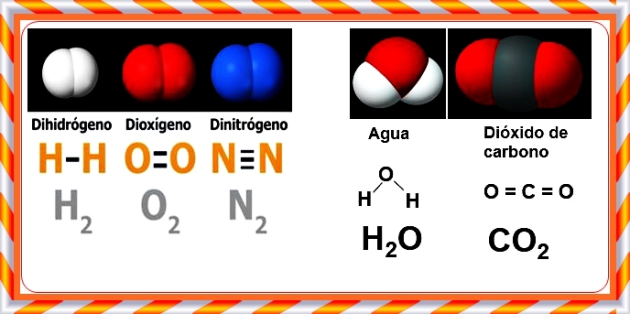
Las moléculas de sustancias simples como el dioxígeno, dihidrógeno, dinitrógeno están conformadas por átomos de un mismo elemento químico en los que los electrones del enlace covalente son igualmente compartidos entre los dos átomos, a diferencia, en las moléculas de los óxidos no metálicos, los electrones son compartidos entre átomos de distintos elementos químicos, en este caso átomos del elemento oxígeno y átomos de un no metal.
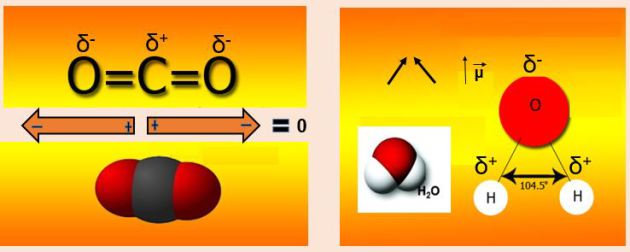
En los ejemplos de las moléculas del dióxido de carbono y el agua los pares de electrones del enlace son desigualmente compartidos, siendo más atraídos por los átomos de oxígeno que por los del otro elemento no metálico. Dado que los átomos de oxígeno atraen más fuertemente los electrones, la densidad de carga negativa está desplazada hacia estos átomos, que como resultado adquieren una carga parcial negativa, δ- mientras que los átomos de los otros elementos no metálicos adquieren una carga parcial positiva, δ+.
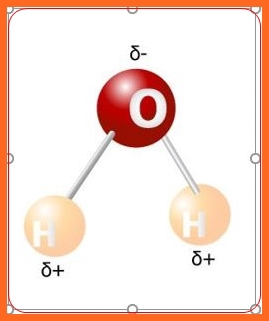
El comportamiento desigual de los electrones de un enlace covalente provoca que aparezcan dos polos, uno negativo sobre los átomos que atraen con mayor fuerza los electrones y uno positivo sobre los que ejercen menor atracción sobre los electrones del enlace.
Definición : Enlace covalente polar y electronegatividad
El enlace covalente en que los electrones se encuentran más atraídos por un átomo que por el otro recibe el nombre de enlace covalente polar, para distinguirlo del que se produce entre átomos iguales que es no polar o apolar.
El poder de atracción que un átomo ejerce sobre los electrones del enlace recibe el nombre de electronegatividad.
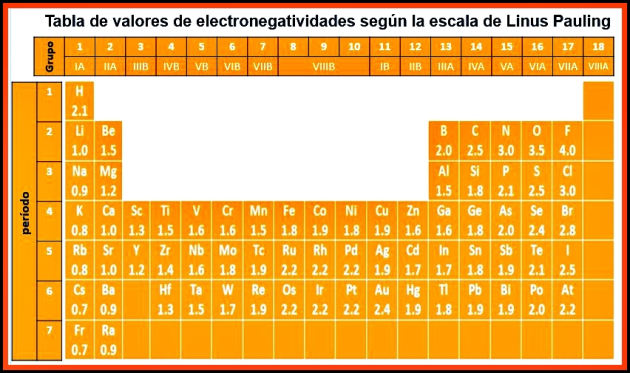
Valores de electronegatividades (Escala Pauling)
Atención :
Se llama polares porque al compartir desigualmente los electrones, se forman dos polos a través del enlace; un enlace covalente polar tiene polos positivo y negativo separados. El polo negativo está centrado sobre el átomo más electronegativo del enlace y el polo positivo está centrado sobre el átomo menos electronegativo del enlace.
Algo de historia :
Linus Carl Pauling químico y bioquímico estadounidense, (1994-1901). Comienza a publicar sus investigaciones sobre la naturaleza del enlace químico a inicio de la década de 1930, a partir de la que publica en 1939 el libro The Nature of the Chemical Bondel, considerado uno de los más importantes trabajos de química jamás publicados. Las investigaciones en esta área le valieron el Premio Nobel de Química en 1954. En 1932 introduce la magnitud de electronegatividad y una escala de electronegatividad, en la que se asigna a los elementos números que representan el poder de atracción de los electrones en un enlace químico, y por medio de la cual puede predecirse el tipo de enlace químico existente entre los átomos.

¿Cómo predecir a partir de los valores de electronegatividad si el enlace es covalente polar o apolar?

Ejemplo : Ejemplo de un enlace covalente polar
El carbono y el oxígeno comparten los electrones de forma desigual debido a las diferencias en la electronegatividad y la capacidad para atraer a los electrones. Su diferencia de electronegatividad es 1,0 por lo que el enlace covalente es polar.
Fundamental :
Para conocer si las moléculas que forman las sustancias es polar o no polar no sólo deberá tenerse en cuenta si el enlace químico entre los átomos de los dos elementos químicos es polar o no polar sino también la simetría de la molécula.
Si analizamos el ordenamiento espacial de la molécula de dióxido de carbono y del agua, en la primera la polaridad[1] de los enlaces carbono-oxígeno queda compensada, debido a la disposición lineal en que se encuentran sus tres átomos, por lo que la molécula en su conjunto no presenta polos resultantes. Por el contrario, la de agua es asimétrica, en la misma los átomos de hidrógeno forman un ángulo de 104,50, por lo que tiene un dipolo resultante que hace que sus moléculas sean fuertemente polares.
No olvidar :
La polaridad de las moléculas depende no solo de la presencia de enlaces químicos polares, sino también de la distribución espacial de los átomos en la molécula, y constituye un elemento del conocimiento importante en la explicación de algunas propiedades de las sustancias.
Saber más :
Los óxidos moleculares como los óxidos no metálicos, presentan relativamente bajas temperaturas de fusión y de ebullición debido a que las interacciones entre las moléculas son de poca intensidad y fáciles de vencer, por lo que cuando funden no se rompen los enlaces covalentes entre sus átomos, sino que solo se vencen las interacciones entre las moléculas.