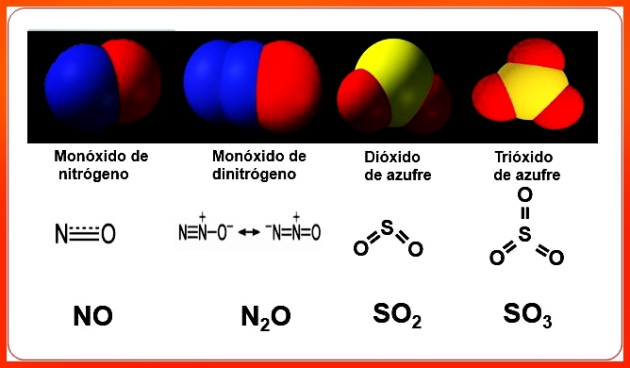
Estructura química de los óxidos no metálicos.
Conoces que los óxidos son sustancias compuestas[1] que de acuerdo a sus propiedades se clasifican en óxidos metálicos[2] y óxidos no metálicos[3]. Estas sustancias manifiestan propiedades físicas[4] muy variadas.
¿Sabías que...? :
Muchos elementos químicos no metálicos forman más de un tipo de óxido no metálico, tal es el caso de los elementos químicos carbono, azufre y nitrógeno, y de ello dependen sus nombres y la diferencia de sus propiedades.
Fundamental :
Los componentes de la estructura química de cualquier sustancia son su composición química[5], tipo de sustancia[6], su ordenamiento espacial[7] y el tipo de enlace químico[8] existente entre los átomos de los elementos químicos que los constituyen.
Saber más :
La geometría molecular[9] o estructura molecular incide directamente en las propiedades físicas y químicas de las sustancias, por ejemplo, en la formación de polos con cargas eléctricas que pueden originar moléculas polares como el agua y moléculas no polares como el tetracloruro de carbono. Una molécula puede ser polar o no, dependiendo de su geometría molecular y no de su tipo de enlace. Al presentar polaridad[10] puede ser atraída por los campos magnéticos, tener solubilidad según la polaridad del disolvente o conducir o no la corriente eléctrica.
No olvidar :
La mayoría de los óxidos no metálicos son sustancias moleculares[11] en las cuales los átomos de los elementos no metálicos y los átomos del elemento oxígeno se encuentran unidos por medio de enlaces covalentes[12]. Entre todas las moléculas que constituyen estas sustancias en sus diferentes estados de agregación (gases, líquidos y sólidos) existen atracciones intermoleculares[13] que las mantienen más o menos unidas.
Los óxidos no metálicos moleculares que se encuentran en estado sólido forman redes cristalinas moleculares.
¿Sabías que...? :
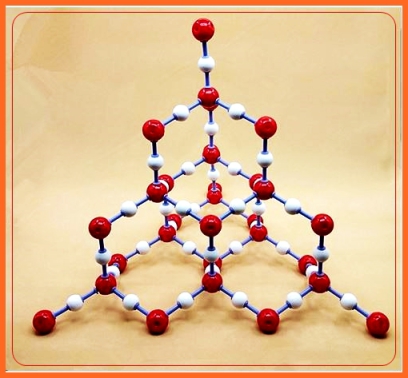
A diferencia de otros óxidos no metálicos, el dióxido de silicio (SiO2), no está formado por moléculas individuales, sino por una red cristalina en la que los átomos de oxígeno y silicio se unen por fuertes enlaces covalentes.